
- 产品详情介绍
- FAQ
- 相关文件
产品描述
D-荧光素钾盐 (D-Luciferin,Potassium Salt) 是一种利用荧光素酶报告基因表达,进行生物活体成像检测的底物。具体作用机制如下,在ATP、镁离子和氧气的作用下,荧光素酶以D-荧光素钾盐作为底物,产生强烈的生物发光信号。活体成像实验中将能够表达荧光素酶的细胞或mRNA等表达载体导入到实验动物体内,而后注射D-荧光素钾盐,通过小动物活体光学成像系统来检测发光强度的变化,进而反映荧光素酶的表达水平。
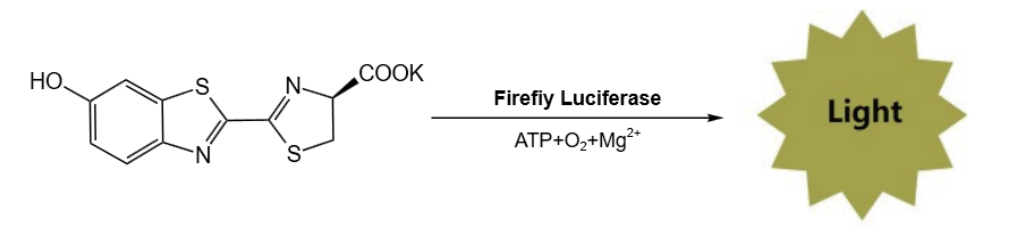
产品优势
纯度高
提高检测灵敏度,减少背景信号
溶解度高
能满足客户实验剂量需求
稳定性好,信号值强
提高实验结果的质量和可重复性
产品组分

适用范围
用于动植物体内的生物发光成像检测。
储存条件
长期保存:-30 ~ -15℃密封避光保存36个月;
运输条件:≤0℃。
Q1. 活体成像钾盐、钠盐和自由酸的区别?
A1. 钾盐和钠盐相比于自由酸更易溶于水,溶解度大于50 mg/ml;钾盐和钠盐对比,有文献提到钠离子对荧光素酶发光反应稳定性存在影响,在活体成像实验中钾盐使用率较高。
Q2. 活体成像钾盐溶解后的稳定性?
A2. 活体成像钾盐粉末用水溶解后可在-80℃保存一年,建议分装保存,减少反复冻融,敏感实验需要现配现用。
Q3. 用活体成像钾盐进行活体成像与绿色荧光蛋白检测体内发光相比,有什么优势?
A3. 活体成像钾盐利用荧光素酶发光机制,产生的偏红光比绿色荧光蛋白的绿光在体内的穿透性强近100倍。且荧光蛋白需要激发光来产生反射光,老鼠的皮毛,皮肤都会产生非特异性荧光,使得信噪比降低;而荧光素酶的特异性很强,在活体成像时信噪比更高。
Q4. 活体成像钾盐的纯度对实验有成影响吗?
A4. 会有影响。高纯度能提供准确稳定荧光信号,利于成像,99%以上的纯度较好,诺唯赞活体成像钾盐试剂纯度达99.8%。而低纯度钾盐中含杂质更多,会抑制细胞内酶作用,致使荧光信号减弱、效果变差,如成像不清、背景噪音增加等,影响实验结论。
Q5. 动物活体成像--活体成像钾盐使用什么注射方式?
A5. 肌肉注射、腹腔注射和尾静脉注射都可以。腹腔注射扩散较慢,持续发光时间长;尾静脉注射扩散快,但发光持续时间很短。
Q6. 动物活体成像--如何确定不同模型的峰值信号时间?
A6. 在外源注射D-荧光素钾盐后,10 min后强度达到稳定的最高点,在最高点持续约20-30 min后开始衰减,在外源给予D-荧光素钾盐10 min检测最佳。生物发光信号的动力学具有组织依赖性,建议新模型创建一个动力学曲线,摸索最佳检测时间。
Q7. 动物活体成像--信号强度过低,可能有哪些原因?
A7. 可能原因包括试剂注射量不足、荧光素酶表达水平低、动物个体差异导致代谢过快或对试剂吸收不良、仪器检测灵敏度设置过低、成像时间选择不当等。需要综合考虑实验各个环节,排查可能存在的问题。
Q8. 植物活体成像--叶片亮度不均匀
A8.可能是以下原因导致:
1. 机械损伤:在侵染过程中,叶片可能受到机械损伤,导致局部亮度不均匀;
2. 侵染不均匀:客户在进行侵染操作时,溶液分布不均匀,导致叶片不同部位吸收的溶液量不同;
3. 实验设计有误:载体会影响蛋白表达量,实验设计需调整;
4. 试剂浓度不均匀:使用的钾盐浓度不均匀,导致叶片吸收不均匀。建议试剂现配现用,使用超声清洗仪(带水槽)超声至完全溶解。
Q9. 如何排除非特异性荧光干扰?
A9. 可以设置空白对照组,即对未进行处理的植物叶片或动物进行成像,获取背景荧光信号,然后在实验数据处理时,将实验组的荧光信号减去空白对照组的信号,以排除非特异性荧光的干扰。


